Last Updated on 4. Juli 2022 by Jacek
Orgovyx, Relumina, Wirkstoff Relugolix bei fortgeschrittenem Prostatakrebs
Tabletten anstatt Spritze. Einmal täglich eingenommene GnRH-Antagonist senkt innerhalb von Tagen den Testosteronspiegel
Orgovyx, Relugolix kann sich möglicherweise zu einem neuen Standard für die Hormontherapie beim fortgeschrittenen Prostatakrebs etablieren.
Wichtigste Vorteile:
- schnelle Wirkung
- keine Spritze notwendig, Reaktion an der Einstichstelle,
- keine Vortherapie mit Bicalutamid
Dosierung:
Orgovx, Relumina, Wirkstof Relugolix (TAK-385) ist ein orale GnRH-Antagonist, der in einem Dosisbereich von 120 mg einmal täglich eingenommen wird. Keine Spritze ist notwendig.
Relugolix wird einmal täglich geschluckt – möglichst immer zur selben Tageszeit. Nur am ersten Tag der Relugolix-Therapie ist eine einmalige Aufsättigungsdosis von 3 Tabletten (360 mg Loading Dose) erforderlich.
Relugolix ist nicht für alle Prostatakrebspatienten gleichermaßen geeignet, die eine Hormonentzugstherapie benötigen. Bei einer kombinierten Hormontherapie, ist Relugolix derzeit noch keine Option.
Relugolix ist eine Monotherapie, beim fortgeschrittenen Prostatakarzinom ist in vielen Fällen die Kombinationstherapie Standard.
Das bedeutet, dass Relugolix derzeit nur für bestimmte Situationen infrage kommt: möglicherweise dann, wenn Betroffene wegen kardiovaskulärer Begleiterkrankungen keine Kombinationstherapie erhalten können oder eine intermittierende Hormonentzugstherapie bevorzugen. Auch als zeitlich begrenzte Hormontherapie in Ergänzung zu einer Strahlentherapie scheint Orgovyx einen Stellenwert zu haben.
Die Filmtablette:
Hellrote, mandelförmige Filmtablette (11 mm [Länge] × 8 mm [Breite]) mit „R“ auf einer Seite und „120“ auf der anderen Seite.
Orgovyx als 120 mg Filmtabletten ist auf dem Deutschem Markt für die Behandlung von Prostatakrebs leider noch nicht verfügbar (Juli 2022). Da die Eurospeiche Zulassung, also auch in Deutschland Anfang Mai 2022 erfolgte, ist es zu erwarten, dass im 4 Quartal in der Apotheke verfügbar sein wird.
Das Medikament wird gleichzeitig für Frauen entwickeln gegen Beschwerden bei Menstruation.
Zulassung von Orgovyx®, Relumina, Wirkstoff Relugolix bei Prostatakrebs
04.05.2022 Die Europäische Kommission hat am 04.05.2022 dem Medikament Orgovyx als 120 mg Filmtabletten (Wirkstoff ist Relugolix) der Firma Myovant Sciences die Zulassung für die folgende Indikation erteilt:
Orgovyx ist indiziert zur Behandlung von erwachsenen Patienten mit fortgeschrittenem hormonsensitivem Prostatakarzinom.
April 2021: Das Unternehmen Myovant Sciences gab bekannt, dass die Europäische Arzneimittel-Agentur (EMA) einen Zulassungsantrag (MAA) für Relugolix zur Behandlung von fortgeschrittenem Prostatakrebs angenommen hat und ein formelles Überprüfungsverfahren einleiten wird.
Dezember 2020: Relugolix unter dem Namen Orgovyx in den USA zugelassen
Myovant Sciences informiert in November 2019, dass der Zulassungsantrag zuerst bei der U.S. Food and Drug Administration (FDA) im zweiten Quartal 2020 vorgesehen ist.
Zulassungsanträge in Europa und Japan sind ebenfalls geplant.
21.Apr.2020: Myovant Sciences hat die Zulassung für Relugolix (Orgovyx) bei bei der FDA in USA in einer Dosis von 120 mg beantragt, zur Behandlung von männlichen Patienten mit fortgeschrittenem Prostatakrebs.
Die Zulassung wird für Dezember 2020 erwartet.
Myovant Sciences hat am 20.11.2019 Ergebnisse der klinischen Studien über Relugolix präsentiert, bei Männern mit fortgeschrittenem Prostatakrebs.
Es handelt sich um eine klinische Phase-3-Studie (HERO) zur Bewertung der Sicherheit und Wirksamkeit von Relugolix bei der Behandlung von Männern mit fortgeschrittenem Prostatakrebs.
23.12.2020 Die US-amerikanische Zulassungsbehörde hat das Präparat Orgovyx® mit den Wirkstoff Relugolix, einen GnRH-Rezeptorantagonisten, für die Behandlung des fortgeschrittenen Prostatakarzinoms zugelassen.
Relugolix ist auch als Relumina oder TAK-385 bekannt.
Relugolix ist der Wirkstoff, TAK-385 ist die Bezeichnung von diesem Wirkstoff bei verschiedenen Studien,
Relumina® ist der Name von in Apotheken verfügbaren Medikament, wird auch unter diesem Namen in Japan bekannt.
Mit Relugolix soll ein Medikament entwickelt werden, dass einerseits das Testosteron unterdrücken kann und andererseits auf angenehme Weise angewendet werden kann.
„Wir hoffen, dass Relugolix in der Lage sein wird, die therapeutischen Vorteile einer direkten Testosteronsuppression mit einem GnRH-Antagonisten in Verbindung mit der Bequemlichkeit einer einmal täglichen Pille bereitzustellen“.
Diese internationale klinische Studie solle entscheidend dafür sein, ob eine Zulassung in den USA, Europa und Asien erreicht werden kann.
Die klinische Phase-III-Studie HERO wurde mit mehr als 1000 Patienten durchgeführt.
Das Unternehmen Myovant Sciences mit Sitz auf den Bermudas verfügt über Niederlassungen in Basel und Kalifornien.
Bei Relugolix TAK-385 handelt es sich um einen oralen GnRH-Antagonisten, der in einem Dosisbereich von 80–120 mg einmal täglich eingenommen wird.
Bisher bekannte Testosteronsenkungsmittel müssten injiziert werden und zu Beginn der Behandlung den Testosteronspiegel erst erhöhen.
Siehe auch => Hormontherapie Prostatakrebs
„Ein einmal täglich oral verabreichter GnRH-Antagonist, der innerhalb von Tagen den Testosteronspiegel senkt, und das Potential hat, den Spiegel nach dem Absetzen schnell wieder anzuheben, könnte Vorteile für Männer mit fortgeschrittenem Prostatakrebs bieten“.
Orgovyx, Relumina® Preis, Kosten
Die Preisabsprache mit den Krankenkassen und Medizinischen Dienst läuft noch (04.07.2022).
Es ist zu erwarten, dass die Zuzahlung für Kassenpatienten bei 10 Euro pro Packung liegen wird.
Für Privat versicherte, auf Privatrezept dürfen die Jahreskosten bei 10 000 liegen..
Der Preis von Relumina (relugolix), den ich im Internet gefunden habe (Versand aus Amsterdam): Preis 1.256,40 EUR , Preis vom 15.06.2020
Phase-II-Studie TAK-385
Schon im Jahr 2015 wurden von Prof. Dr. Neal Shore vom Carolina Urologic Research Center, Myrtle Beach, USA die Ergebnisse Phase-II-Studie bei Patienten mit fortgeschrittenem Prostatakarzinom präsentiert. Verglichen wurde TAK-385 mit dem GnRH-Analogon Leuprorelin (mehr bekannt als 3-Monats Depot-Spritze).
Die Studie war so konzipiert, dass Patienten mit diagnostiziertem Prostatakarzinom, einem Testosteronspiegel von über 150 ng/dl, einem PSA-Wert von größer 2 ng/ml, bei denen eine Hormontherapie ADT (Androgendeprivationstherapie) empfohlen war, entweder TAK-385 (80 oder 120 mg, einmal täglich) oder Leuprorelin (22,5 mg subkutan alle 12 Wochen) über 48 Wochen erhielten.
Der primäre Endpunkt war ein Kastrationsniveau durch TAK-385 (Testosteronspiegel < 50 ng/dl) zwischen Woche 5 und 24.
Was sich schon am Ende von der ersten Woche zeigte, war, dass sich unter TAK-385 der Testosteronspiegel verglichen zum Ausganswert um im Median 95 % auf 21 ng/dl senkte. Unter Leuprorelin senkte sich der Testosteronspiegel um 29 % auf 282,9 ng/dl.
Zwischen Woche 5 und 24 konnte bei 88 % der TAK-385-Patienten und 92 % der Leuprorelin-Patienten konnte ein Testosteron-Spiegel von < 50 ng/dl gehalten werden.
Fazit: Die Autoren schließen aus diesen Ergebnissen, dass TAK-385 den Testosteronspiegel sehr schnell senkte.
Dieser niedrige Spiegel von kleiner als 50 ng/dl konnte über 24 Wochen gehalten werden.
Phase-III die HERO-Studie, Ergebnisse
Bei der HERO-Studie handelt es sich um eine randomisierte, offene klinische Phase-III-Studie bei Männern mit androgensensitivem fortgeschrittenem Prostatakarzinom, die mindestens ein Jahr lang androgenentzugtherapie benötigen.
Etwa 1.125 Patienten Weltweit wurden an dieser Studie teilnehmen: Nord-und Südamerika. Europa, und das Asiatische Pazifik-Region.
Patienten, die an der Studie teilgenommen haben, wurden 2:1 randomisiert, um orales Relugolix 120 mg einmal täglich oder Leuprolidacetat 3-monatige Depotinjektion zu erhalten.
Wie Myovant Sciences am 20.11.2019 berichtet und am 11.06.2020 bestätigt,
In der primären Endpunkt-Responder-Analyse erreichten 96,7% der Männer eine anhaltende Testosteronsuppression bis zum Kastrationsspiegel von 0,5 ng/ml (von Woche 5 bis Woche 48).
Relumina Relugolix vs. Hormospritze mit Leuprolidacetat
Fünf wichtige sekundäre Endpunkte zeigten in der Studie die Überlegenheit gegenüber Leuprolidacetat, darunter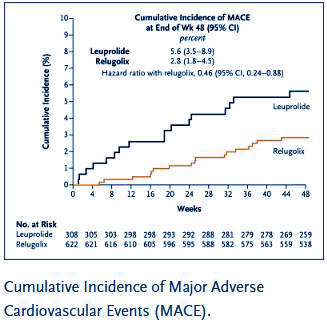
- eine schnelle Unterdrückung von Testosteron an Tag 4 und 15,
- die starke Unterdrückung von Testosteron an Tag 15,
- eine schnelle Unterdrückung von prostataspezifischem Antigen (PSA) an Tag 15 und
- die Unterdrückung des Follikelstimulationshormons (FSH) in Woche 24.
Die Ergebnisse zeigten keinen Testosteron-Flare nach der Einleitung von Relugolix.
innerhalb von 90 Tagen nach Beendigung der Behandlung kehrte der mittlere Testosteronspiegel zurück auf ein normales Niveau.
Quelle: https://www.nejm.org/…/10.1056/
!!! In der Studie waren nach 48 Monaten 74% der metastasierten Patienten unter Relugolix kastrationsresistent, verglichen mit 75% der Patienten unter Leuprolid, also kaum unterschiedlich.
Relugolix Vorteile bei kardiovaskulären Vorerkrankungen
Im Vergleich mit Firmagon / Degarelix Spritze, keine starke Reaktion an der Einstichstelle, da es keine Einstichstelle gibt.
Die neuen Phase-III-Daten (August 2021) der HERO-Studie zum oralen GnRH-Antagonisten Relugolix bestätigen die Vorteile bei Patienten mit kardiovaskulären Vorerkrankungen.
Bei Studieneinschluss hatten 80 % der Patienten mindestens einen kardiovaskulären oder zerebrovaskulären Risikofaktor und 14 % ein schwerwiegendes kardiovaskuläres Ereignis in der Anamnese.
Patienten, die mit Relugolix behandelt wurden, hatten ein um 54 % geringeres relatives Risiko für schwerwiegende unerwünschte kardiovaskuläre Ereignisse im Vergleich zu Leuprorelin.
In der Subgruppe der Patienten mit einem schwerwiegenden kardiovaskulären Ereignis in der Anamnese war der Unterschied noch deutlicher mit einer 80 %igen Reduktion des relativen Risikos.
Relugolix bei Menstruation Beschwerden bei Frauen
Mit Relugolix wurde 2017 von Takeda in Japan eine Phase-II Studie für die Behandlung von Endometriose und Uterus myomatosus durchgeführt.
Uterus myomatosus = gutartige Muskelgewebeknoten der Gebärmutter.
Endometriose ist eine gutartige Erkrankung von Frauen: Gebärmutterschleimhaut-ähnliches Gewebe wächst nicht nur in der Gebärmutterhöhle, sondern auch an Stellen, wo es eigentlich nicht hingehört.
QUELLE: Myovant Wissenschaften 2017 und 2019
.
Hallo Jacek,
vielen Dank für die schnelle Antwort. Du hast mir sehr geholfen.
Gruß
Reinhold
Hallo Jacek,
ich habe Deinen Artikel über Relugolix Relumina vom 14.2.2022 gelesen.
Vielen Dank für diese wichtige Information. Ich nehme an, dass die EU-Zulassung auch in Deutschland gilt. Was muss ich machen, um das Produkt zur Behandlung meines Prostatakrebses (ADT) zu kaufen? Wieviel kostet es voraussichtlich? An wen muss ich mich wenden?
Besten Dank
Reinhold
Hallo Reinhold,
ich haben diesen Artikel gerade bearbeitet.
Relugolix Relumina ist in Deutschland/Europa unter dem Namen Orgovyx seit Mai 2022 zugelassen.
Ich vermute in der Apotheke wird das Medikament in dem viertem Quartal verfügbar.
Der Preis ist mir noch nicht bekannt, aber ich vermute, für eine Monatspackung für Kassepatienten die Zuzahlung bei 10 Euro liegen wird.
Gruß, Jacek
Hallo Jacek,
so weit so gut, aber wer verschreibt Relugolix, wenn dieses Medikament in der EU noch nicht zugelassen ist ?
Hallo Christian,
leider muss man auf die Zulassung in EU geduldig warten:
Immerhin schon in April 2021 hat der Produzent Myovant Sciences die Zulassung in EU beantragt.